Luca Di Lullo, Antonio De Pascalis, Antonio Bellasi
La sindrome epatorenale (HRS) continua a rappresentare una delle principali complicazioni della cirrosi scompensata con esito spesso fatale in assenza di trapianto di fegato che rappresenta l’unica vera terapia definitiva. Le difficoltà nel valutare con precisione la funzione renale nel paziente con cirrosi rimangono dovute alle limitazioni imposte dal dosaggio della sola creatinina sierica (Cr) e nella conseguente stima del tasso di filtrazione glomerulare (GFR).
Una novità importante nei criteri diagnostici per HRS si basa sul fatto di codificare la HRS come una forma speciale di danno renale acuto (AKI) con la possibilità di una precoce identificazione della disfunzione renale nei pazienti con cirrosi.
I biomarcatori di danno renale non sono, però, in grado di distinguere tra HRS ed altre nefropatie anche se i nuovi marcatori di danno tubulare potrebbero rappresentare un indubbio passo in avanti. A causa delle difficoltà di valutazione della funzione renale in corso di cirrosi e dei diversi criteri diagnostici di HRS nonché del rigore con cui vengono applicati, l’incidenza e la prevalenza precisa dell’HRS è sconosciuta, ma è probabile che l’HRS si verifichi più comunemente del previsto. La fisiopatologia dell’HRS è saldamente radicata nell’impostazione della riduzione progressiva del flusso sanguigno renale (RBF) come risultato dell’ipertensione portale e della vasodilatazione splancnica. La cascata infiammatoria innescata dalla traslocazione batterica e dall’endotossinemia, sempre più riconosciuto come importante nelle manifestazioni di acuta su insufficienza epatica cronica, può anche giocare un ruolo significativo nella fisiopatologia della HRS. Il pilastro del trattamento rimane la terapia vasopressoria con albumina nel tentativo di invertire la vasodilatazione splancnica e migliorare la RBF.
Altri interventi come la terapia renale sostitutiva, lo shunt transgiugulare intraepatico porto-sistemico (TIPS) e i sistemi di supporto epatico artificiale hanno un ruolo molto limitato per migliorare gli esiti dell’HRS. Il trapianto di fegato rimane il trattamento definitivo per l’HRS. La frequenza del trapianto simultaneo di fegato e rene (SLKT) è aumentata drasticamente negli ultimi anni grazie anche ai cambiamenti nelle politiche di assegnazione degli organi. Ciò ha comportato una necessità più urgente di prevedere con precisione il recupero del rene nativo da HRS dopo il solo trapianto di fegato, per evitare inutili SLKT
E’ risaputo che il dosaggio della creatinina sierica non rappresenta un marcatore accurato della disfunzione renale nella cirrosi. La produzione di creatina, precursore della creatinina, è compromessa nella disfunzione epatica. I pazienti con cirrosi scompensata, inoltre, presentano una riduzione della massa muscolare ed un’ aumentata la secrezione tubulare di creatinina. Considerati insieme, tutti questi fattori riducono la concentrazione sierica di creatinina, rendendola un marcatore non sufficientemente accurato della funzione renale nella cirrosi. Valutare la funzione renale misurando il GFR è il metodo più affidabile e accurato, ma è costoso e richiede tempo. Nei soggetti con cirrosi, è stato dimostrato che la clearance della creatinina presenta una scarsa accuratezza nella previsione del GFR misurato. Il recente sviluppo di equazioni del GFR che integrano il valore della creatinina sierica con biomarcatori di origine renale appaiono promettenti. Rispetto alle equazioni CKD-EPI cistatina C (2012)14 e Cr-Cistatina C (2012), l’equazione Cr-Cistatina C GFR per la cirrosi ha evidenziato un’accuratezza significativamente più elevata, soprattutto nel discriminare i pazienti con cirrosi che avevano GFR < 60ml/min con un’area sotto la curva concentrazione-tempo (AUC) di 0,91 rispetto a MDRD e CKD-EPI Cr (2009). Negli ultimi anni è stato discusso il ruolo di diversi biomarcatori urinari di AKI in merito alla possibilità di riuscire a determinare l’eziologia dell’AKI nei pazienti con cirrosi. Fagundes et al. hanno osservato come i livelli di lipocalina associata alla gelatinasi neutrofila (NGAL) urinaria sono stati dosati a livelli significativamente elevati nei pazienti con cirrosi e ATN rispetto a quelli con azotemia prerenale e HRS. Un pannello di biomarcatori urinari AKI tra cui NGAL, interleuchina-18 (IL-18), molecola di lesione renale-1 (KIM-1), la proteina legante degli acidi grassi di tipo epatico (L-FABP) e l’albumina, inoltre, permettono di differenziare i pazienti con ATN da quelli con azotemia prerenale o HRS.La prevalenza dell’AKI e dell’HRS nella cirrosi in studi pubblicati mostra variazioni significative dovute alla definizione dell’HRS impiegato e al modo in cui vengono applicati rigidamente i criteri di inclusione/esclusione. In una recente rassegna è emerso come il 19% dei pazienti ospedalizzati con cirrosi ha avuto AKI / insufficienza renale acuta, così come tra quelli con insufficienza renale acuta, circa il 17% ha avuto una diagnosi di HRS In uno studio prospettico multicentrico su 188 pazienti ospedalizzati con cirrosi e AKI diagnosticati secondo i criteri proposti da ADQI e IAC2, circa il 9% e il 21% dei soggetti ha ricevuto rispettivamente una diagnosi di HRS e ATN. Va ricordato che possono esistere due quadri fondamentali di HRS:
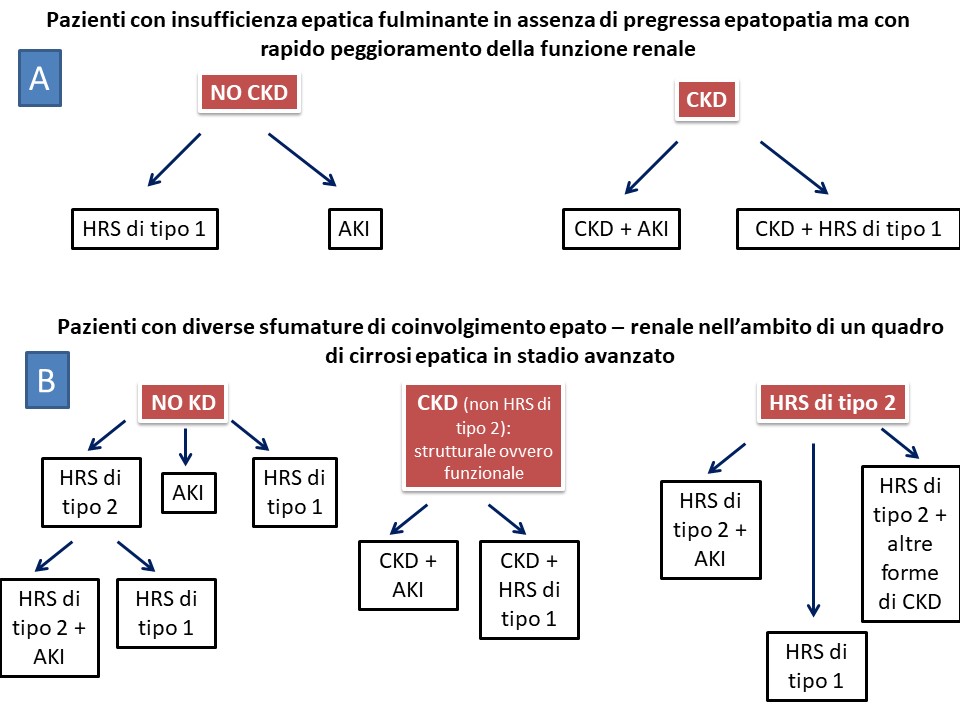
- Una sindrome caratterizzata da insufficienza epatica fulminante in assenza di pregressa epatopatia ma con rapido peggioramento della funzione renale (HRS di tipo 1) (Fig. 1A)
- Una sindrome caratterizzata da diverse sfumature di coinvolgimento epato – renale nell’ambito di un quadro di cirrosi epatica in stadio avanzato (HRS di tipo 2) (Fig. 1B)
La fisiopatologia della sindrome epato – renale presenta aspetta peculiari e non del tutto ancora chiariti; sono, infatti, diversi gli attori in gioco ma i due fattori che più di altri contribuiscono all’instaurarsi del quadro clinico sono rappresentati dalle alterazioni dell’emodinamica renale e da quelle del sistema dell’ossido nitrico (Fig. 2).

Veniamo al punto più controverso, ossia quello legato al trattamento della HRS. Una volta stabilita la diagnosi di AKI-HRS, la terlipressina, analogo della vasopressina è considerata il farmaco vasocostrittore di prima linea nel trattamento dell’HRS; attualmente il farmaco, disponibile sul territorio europeo, non lo è negli Stati Uniti. La terlipressina viene generalmente somministrata inizialmente ad una dose di 0,5-1 mg in bolo endovenoso (IV) ogni 4-6 ore (h); la dose può essere aumentata a 2 mg in bolo IV ogni 4-6 ore se si documenta una riduzione inferiore al 25% del valore di creatinina sierica dopo 3 giorni e non si verificano effetti collaterali. La terlipressina deve essere interrotta dopo un massimo di 14 giorni di trattamento se non vi è alcun miglioramento della funzione renale. Laddove la terlipressina non fosse disponibile, l’octreotide, un analogo della somatostatina in combinazione con la midodrina, un agonista alfa-adrenergico, rappresenta l’opzione farmacologica raccomandata per il trattamento dell’HRS di tipo I. L’ Octreotide viene somministrata al dosaggio di 100 – 200 microgrammi per via sottocutanea ogni 8 ore
La Midodrina, invece, viene somministrata al dosaggio di 7,5 e fino a 12.5 mg per via orale tre volte al giorno; la dose deve essere titolata per ottenere un aumento di 15 mm Hg della pressione arteriosa media. Anche la Noradrenalina, agonista alfa-adrenergico , può essere impiegata nel trattamento della HRS di tipo 1 anche se è necessario un monitoraggio cardiaco in un’unità di terapia intensiva. La noradrenalina viene somministrata a 0,5-3 mg/h in infusione continua per via endovenosa, titolando il dosaggio per ottenere un aumento di 10 mm Hg della pressione arteriosa media. L’albumina deve essere somministrata in combinazione con qualsiasi regime farmacologico vasocostrittore. con una dose raccomandata che varia da 20 a 40 g IV una volta al giorno dopo la somministrazione della dose iniziale (1 g/kg/giorno per 2 giorni).
Il trattamento non farmacologico della sindrome epato – renale si basa su tre tipologie di intervento: terapia sostitutiva della funzione renale (RRT), shunt intraepatico transgiugulare intraepatico porto-sistemico (TIPS) e sistema di ricircolo molecolare adsorbente (MARS). Il trapianto di fegato, quando disponibile e possibile, è chiaramente il trattamento definitivo per la HRS di tipo 1. La SLKT (trapianto simultaneo fegato – rene) è la procedura di scelta qualora non ci si aspetti un recupero della funzione renale nativo dopo la fase acuta della malattia.
Secondo le raccomandazioni del Summit Consensus SLKT pubblicate nel 2012, i candidati al trapianto di fegato con AKI erano qualificati per la SLKT se avevano un AKI di stadio 3 per 4 settimane ovvero GFR (misurato con clearance dello iotolamato ≤25 ml/min) ovvero ancora GFR stimato dall’equazione MDRD-6 ≤35 ml/min per 4 settimane.
I candidati affetti da CKD erano ritenuti idonei se avevano valori di GFR misurato con clearance dello iotalamato ≤30 ml/min ovvero GFR stimato da equazione MDRD-6 ≤40 ml/min, proteinuria ≥2 g/giorno, una percentuale superiore al 30% di glomerulosclerosi globale o fibrosi interstiziale o malattia metabolica per almeno 3 mesi.
Nelle figure 3, 4, 5 e 6 vengono schematizzati gli algoritmi decisionali per la diagnosi e la terapia dell’AKI correlata alla presenza di sindrome epato – renale
Le attuali terapie farmacologiche con vasopressori, come la terlipressina e la noradrenalina, sono efficaci nel migliorare la funzione renale, sebbene sia chiaramente necessaria una terapia più efficace per aumentare le percentuali di remissione della HRS.
Il trapianto di fegato rimane il trattamento definitivo per l’HRS; l’attuale sfida principale è l’identificazione accurata dei pazienti che richiedono la SLKT rispetto al solo trapianto di fegato . Un algoritmo pratico, robusto e basato sull’evidenza per prevedere il recupero del rene nativo dopo trapianto di fegato rimane un “unmeet need” e necessita di ulteriori studi clinici “ad hoc”
Letture consigliate
- Epstein M. Hepatorenal syndrome: emerging perspectives of pathophysiology and therapy. J Am Soc Nephrol. 1994; 4:1735–53.
- Papadakis MA, Arieff AI. Unpredictability of clinical evaluation of renal function in cirrhosis. Prospective study Am J Med. 1987; 82:945–52
- Levey AS, Stevens LA, Schmid CH, et al. A new equation to estimate glomerular filtration rate. Ann Intern Med. 2009; 150:604–12
- Belcher JM, Sanyal AJ, Peixoto AJ, et al. Kidney biomarkers and differential diagnosis of patients with cirrhosis and acute kidney injury. Hepatology. 2014; 60:622–32
- 5. Bellomo R, Ronco C, Kellum JA, et al. Acute renal failure – definition, outcome measures, animal models, fluid therapy and information technology needs: the Second International Consensus Conference of the Acute Dialysis Quality Initiative (ADQI) Group. Crit Care. 2004; 8:R204–12
- Ginès PAP, Lenz K, Møller S, Moore K, Moreau R, Merkel C, Ring-Larsen H, Bernardi M. EASL clinical practice guidelines on the management of ascites, spontaneous bacterial peritonitis, and hepatorenal syndrome in cirrhosis. J Hepatol. 2010; 53:397–417.
- Gluud LL, Christensen K, Christensen E, et al. Systematic review of randomized trials on vasoconstrictor drugs for hepatorenal syndrome. Hepatology. 2010; 51:576–84.
- Gluud LL, Christensen K, Christensen E, et al. Terlipressin for hepatorenal syndrome. Cochrane Database Syst Rev. 2012 CD005162
- Capling RK, Bastani B. The clinical course of patients with type 1 hepatorenal syndrome maintained on hemodialysis. Ren Fail. 2004; 26:563–8.
- Witzke O, Baumann M, Patschan D, et al. Which patients benefit from hemodialysis therapy in hepatorenal syndrome? J Gastroenterol Hepatol. 2004; 19:1369–73
- O’Leary JG, Levitsky J, Wong F, et al. Protecting the kidney in liver transplant candidates Practice- Based Recommendations from the American Society of Transplantation Liver and Intestine Community of Practice. Am J Transplant. 2016
- Nadim MK, Sung RS, Davis CL, et al. Simultaneous liver-kidney transplantation summit: current state and future directions. Am J Transplant. 2012; 12:2901–8
